Pľúcne onkofórum 2023 – 5. 12. 2023. Hotel Lindner, Bratislava
Autor: MUDr. Lucia Denková
Približne 5% metastatických nemalobunkových karcinómov pľúc (NSCLC) vykazuje translokácie postihujúce ALK gén. Prevažne sa vyskytuje u ženského pohlavia, u celoživotných nefajčiarov alebo bývalých fajčiarov. Pacienti sú prevažne mladšieho veku, bez EGFR či BRAF mutácií. Jedná sa o veľmi agresívne ochorenie, ktoré veľmi rýchlo metastázuje do CNS. Už na začiatku diagnózy má 25 – 40 % pacientov metastázy v CNS a odhaduje sa, že u 50 – 60 % sa vyskytnú mozgové metastázy v priebehu ich ochorenia.
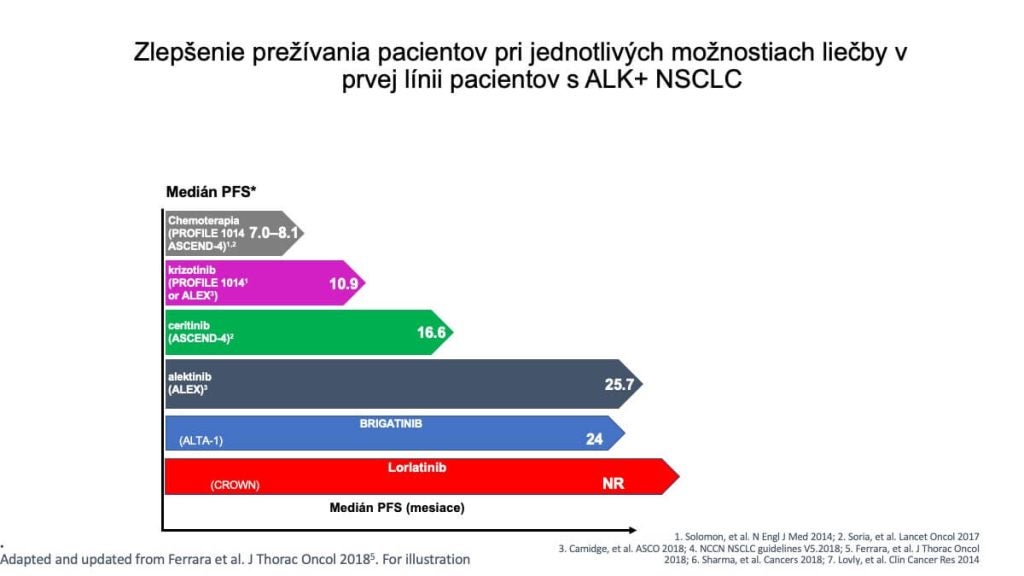
Krizotinib bol prvý perorálny tyrozínkinázový inhibítor, ktorého ciele sú tyrozínkinázy ALK, MET a ROS1. Krizotinib preukázal v dvoch klinických štúdiách PROFILE 1005 a 1001, markantnú protinádorovú aktivitu u pacientov s pokročilým ALK+ NSCLC, s objektívnou RR priemerne 60% a mediánom PFS 8,1 mesiaca v jednej štúdii a 9,7 mesiaca v druhej. Účinnosť krizotinibu v 1. línii liečby potvrdila klinická štúdia PROFILE 1014. Preukázala superioritu krizotinibu počtom objektívnych RR (74 % pre krizotinib vs. 45 % pre chemoterapiu, p < 0,0001), ako aj splnenie primárneho cieľa (medián PFS 10,9 mesiaca s krizotinibom vs. medián PFS 7,0 mesiacov pre chemoterapiu, HR=0,45, p < 0,0001). Na podklade týchto výsledkov bol krizotinib ako prvý ALK TKI inhibítor schválený Úradom pre kontrolu potravín a liečiv (FDA – Food and Drug Administration) v roku 2011 a Európskou liekovou agentúrou (EMA – European Medical Agency).
Nenaplnená potreba pre zlepšenie systémovej aj intrakraniálnej účinnosti viedla k vývoju nových ALK inhibítorov, ktoré vykazujú vyššiu účinnosť proti natívnemu ALK onkoproteínu, širšie pokrytie proti rezistentným mutáciám a výrazné zlepšenie penetrácie do CNS.
Na konci roku 2017 pozitívne výsledky štúdie ALEX zaznamenali začiatok novej éry liečby ALK+ NSCLC. Alektinib, ALK inhibítor druhej generácie zlepšil ako PFS tak aj OS v priamom porovnávaní voči krizotinibu. Záverečná analýza potvrdila predĺženie PFS hodnotené skúšajúcim pri liečbe alektinibom v porovnaní s krizotinibom (medián PFS 34,8 vs. 10,9 mesiaca) ako aj pri hodnotení IRC (Independent Review Committee) 25,7 vs. 10,4 mesiaca.
Alektinib preukázal účinnosť u pacientov s prítomnými / neprítomnými CNS metastázami na začiatku liečby. Medián PFS po 5 rokoch bol u pacientov liečených alektinibom a s prítomným mozgovými metastázami na začiatku liečby 25,4 mesiaca (95 % CI 9,2 – NR, HR= 0,37, 95 % CI: 0,23 – 0.58) a u pacientov bez prítomnosti mozgových metastáz na začiatku liečby bol medián PFS 38,6 mesiaca (95 % CI 22,4 – NR, HR=0,46, 95 % CI 0,31–0,68). .
Brigatinib, druhogeneračný ALK inhibitor bol schválený na základe štúdii ALTA a ALTA-1L. ALTA-1L bola multicentrická zaslepená, randomizovaná štúdia 3. fázy u ALK TKI neliečených pacientov s ALK+ NSCLC, kde sa porovnávala účinnosť brigatinibu a krizotinibu. Randomizácia bola 1:1. Primárny koncový ukazovateľ bol PFS. Hodnotenie mediánu PFS podľa BIRC (Blinded Independent Review Committee) pre brigatinib bol 24,0 mesiacov (18,5 – 43,2) a pre krizotinib 11,1mesiaca (9,1 – 13,0), HR=0,48 (95 % CI: 0,35 – 0,66); p<0,0001. Systémové PFS hodnotené investigátormi pre brigatinib bolo 30,8 mesiaca (21,3 – 40,6) a pre krizotinib 9,2 mesiaca (7,4 – 12,7), HR=0,43 (95 % CI: 0,31 -0,58); p<0,0001. Brigatinib dosiahol vysokú intrakraniálnu účinnosť u pacientov s východiskovými mozgovými metastázami, u týchto pacientov znížil riziko progresie alebo smrti o 75% v porovnaní s krizotinibom. Medián PFS u pacientov s mozgovými metastázami na začiatku liečby bol 24,0 mesiacov (18,4 – 34,9) vs. 5,6 mesiaca (3,8 – 9,2) pre krizotinib, HR=0,25 (95 % CI: 0,14 – 0,46) p<0,0001. U pacientov bez mozgových metastáz medián PFS pre brigatinib bol 29,3 mesiaca (15,7 -NR) vs. krizotinib 15,6 mesiaca (9,5 – 21,1) HR=0,62 (0,43 – 0,91) p=0,0131. Zlepšenie PFS hodnotené podľa BIRC bolo konzistentné vo všetkých podskupinách (vek, rasa, pohlavie, abúzus fajčenia, prítomné mozgové metastázy na začiatku liečby, či u pacientov predliečených chemoterapiou). OS dáta zostávajú otvorené. 47 % pacientov (n=65) liečených krizotinibom prešlo na liečbu brigatinibom počas trvania štúdie, preto je náročné tieto údaje objektívne vyhodnotiť
Treťogeneračný ALK inhibítor lorlatinib, bol vyvinutý špeciálne tak, aby mal vyššiu účinnosť proti všetkým známym rezistentným ALK mutáciám a lepšiu farmakokinetiku biologickej dostupnosti do CNS. Toto očakávanie potvrdila klinická štúdia fázy 3 – CROWN. Klinická štúdia CROWN bola globálna, randomizovaná štúdia fázy 3 porovnávajúca lorlatinib s krizotinibom u pacientov s pokročilým ALK-pozitívnym NSCLC, ktorí predtým nedostávali žiadnu systémovú liečbu metastatického ochorenia. PFS podľa hodnotenia investigátorov bolo dlhšie pri liečbe lorlatinibom oproti krizotinibu. Medián PFS pre lorlatinib nebol ešte stanovený – NR (95 % CI: NR – NR) a pre krizotinib bol 9,1 mesiaca (95 % CI: 7,4 – 10,9) HR=0,19; 95 % CI: 0,131 – 0,274. Po 36 mesiacoch bolo 64% pacientov stále na liečbe lorlatinibom. Intrakraniálne PFS u pacientov s východiskovými metastázami v mozgu nebolo zatiaľ dosiahnuté, ako aj u pacientov bez mozgových metastáz na začiatku liečby.
Na základe týchto klinických štúdií máme k dispozícii viacej molekúl ALK TKI ako možnosť liečby pacientov s mNSCLC ALK + prestavbou. Chýba nám priame porovnanie „head to head“ medzi alektinibom, brigatinibom a lorlatinibom. Ako si teda správne vybrať vhodnú liečbu ALK TKI? Faktory ovplyvňujúce výber liečby sú napríklad, o aké ochorenie ide, aká je línia liečby, správanie ochorenia, prítomnosť mozgových metastáz, molekulárny profil tumoru a možnosti ďalšej liečby. Zo zameraním na pacienta je nutné prihliadať na tolerabilitu resp. toxicitu lieku, komorbidity pacienta a jeho konkomitantnú medikáciu, preferenciu zaťaženia tabletkami a v neposlednom rade vek. Ako si vybrať správny ALK TKI inhibítor do I. línie? Vieme už, že príchod vyššie generačných ALK inhibítorov potlačil používanie krizotinibu a ceritinibu v I. línii. Pri výbere vhodného lieku pre pacienta nám môžu pomôcť, výsledky
PFS v klinických štúdiách, v neposlednom rade napríklad počet tabletiek, veľmi dôležité je spektrum nežiadúcich účinkov, účinnosť proti najčastejším rezistentným mutáciám a efektivita v CNS. Podľa mediánu PFS v spomínaných klinických štúdiách je účinnosť alektinibu a brigatinibu obdobná, pre lorlatinib nie je ešte stanovené mPFS čo sa týka celkovej účinnosti, ale javí sa tendencia ku podobnému PFS ako u alektinibu a brigatinibu, možno o čosi lepšiemu. Účinnosť v CNS sa javí najlepšia u lorlatinibu, potom u brigatinibu a u alektinibu. Čo sa týka bezpečnosti, najzávažnejšie nežiadúce účinky sa zaznamenali u lorlatinibu zo strany porúch kognitívnych funkcií a dopad na zmeny nálad. Počas liečby lorlatinibom sa vyskytli hlavne poruchy lipidového metabolizmu. Počas liečby alektinibom sa zaznamenalo vyššie percento zvýšenia pečeňových transamináz, myalgia a chudokrvnosť. V prípade brigatinibu boli najčastejšími nežiaducimi účinkami hypertenzia, hnačka a zvýšenie pečeňových transamnináz. Spektrum pokrytia rezistentných mutácii má najväčšie lorlatinib vrátane mutácie G1202R, ktorú inhibuje aj brigatinib a mutácie „gatekeeper mutation“ L1196M. Alektinib pokrýva najmenej rezistentných mutácii.
Lorlatinib, alektinib a brigatinib sú ALK inhibítory novej generácie, indikované do I. línie liečby mNSCLC ALK+ na základe head to head klinických štúdií oproti krizotinibu. Nie sú k dispozícii priame porovnania 2. generačných ALK TKI s lorlatinibom. Metódy prispôsobeného nepriameho porovnania MAIC (Matching adjusted indirect comparison) pomáhajú upraviť rozdiely v pacientských populáciách v jednotlivých RCT (real clinical trial), t. j. distribúciu charakteristík pacientov, zrelosť údajov a cross-over. Na svetovom kongrese WCLC v roku 2023, boli odprezentované tieto výsledky nepriameho porovnania brigatinibu a alektinibu oproti lorlatinibu. Celkovo lorlatinib preukázal lepšie PFS v porovnaní s alektinibom (ALEX) a brigatinibom (ALTA-1), ale rozdiely boli zanedbateľné. Zatiaľ, čo riziko NÚ stupňa 3 a viac bolo vyššie pri lorlatinibe v porovnaní s alektinibom a brigatinibom, neboli žiadne rozdiely v iných skúmaných koncových ukazovateľoch bezpečnosti . Táto štúdia podporuje súhrn dôkazov o porovnateľnej účinnosti a bezpečnosti lorlatinibu, alektinibu a brigatinibu ako liečby I. línie mNSCLC ALK+.
MUDr. Lucia Denková
Onkologické odd. KPF I a FD LF SZU a UN
Bratislava Ružinov
Dátum prípravy: 14. 2. 2024
C-APROM/SK/ALUN/0050
Zoznam použitej literatúry:
Alice T. Shaw, M.D_2020_First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer_The, Camidge 2018 ASCO Abstract 9043, Camidge DR et al. J Clin Oncol 2020 Brigatinib-Alunbrig, Camidge.NEJM.2018, D. Ross Camidge_2020_Brigatinib Versus Crizotinib in Advanced ALK Inhibitor Naive ALKPositive Non-Sm, Elsayed M Frontiers in Oncology_2021, ESMO Clinical Practice Guideline NSCLC_2023_ESMO Clinical Practice Guideline NSCLC_2023, Ferrara, et al._2018_Ferrara, et al. J Thorac Oncol 2018_J Thorac Oncol 2018, Garcia CA et al. WCLC 2023, Poster EP 12.02-06, Gettinger.Lancet Oncol.2016, Karachaliou N, et al, OncoTargets and Therapy 2019 12 4567–4575_OncoTarge, Kim D-W, et al. J Clin Oncol. 2016;34(suppl) [abstract 9007], Kim.J Clin Oncol.2017, Ou SHI,_2021_Ou SHI, et al, Translational Oncology 14 (2021), Steeg PS, et al. Nat Rev Cancer. 2011, 11(5)_352-63, Solomon et al.2020 ESMO LBA2, Wang Y et al. J Natl Cancer Inst 2016;108;pii;djv342, Lovly and Shaw. Clin Cancer Res 2014, Solomon BJ,et al. N Engl Med. 2014,371(23):2167-2177-1014, Sanjay Popat,et,al. 2021 ESMO .e-Poster 1195P-ALTA-1L, Rothensein et ak_2018_ALK inhibitors, resistance development, clinical trials_Curr Oncol. 2018 Jun;2, Sasaki T,_2010_Sasaki T, et al. Eur J Cancer 2010 46 1773–80, Sharma, et al._2018_Sharma, et al. Cancers 2018, Shaw A, et al. Clin Cancer Res 2011, Zhang.Clin Cancer Res.2016, Wang et al. J Clin Oncol 2019, Solomon_4/2023_First-line lorlatinib versuscrizotinib in patients with advanced, ALK-positive NSCLC

