

Еdukačný webinár TAKEDA – 24. 9. 2020 a 15. 10. 2020
Personalizovaná profylaktická liečba v manažmente pacienta s hemofíliou A – skúsenosti z klinickej praxe.
Autor: MUDr. Jaroslava Feketeová
Spoločnosť TAKEDA zorganizovala v dňoch 24.9.2020 a 15.10.2020 pre hematológov na Slovensku edukačný online webinár, ktorého obsahom bola prednáška MUDr. Denisy Jankovičovej, PhD. z Národného hemofilického centra a Kliniky hematológie a transfuziológie LFUK, SZU v Bratislave pod názvom Personalizovaná profylaktická liečba v manažmente pacienta s hemofíliou A – skúsenosti z klinickej praxe.
Ako povedala v úvode prezentácie MUDr. Jankovičová, cieľom stretnutia bola výmena skúseností z klinickej praxe medzi hematológmi, ktorí nastavujú pacientov s hemofíliou na profylaktickú liečbu, čo dnes označujeme termínom „personalizovaná profylaxia“.
Všetci lekári, ktorí sa starajú o pacientov s hemofíliou, vedia, že základnou klinickou manifestáciou ochorenia je krvácanie, pri ťažkej forme hemofílie je to spontánne krvácanie, predovšetkým do pohybového aparátu.
Hemofília je nevyliečiteľné ochorenie, avšak dobre liečiteľné. Liečbou je náhrada koagulačného faktora intravenózne, a to faktora VIII alebo IX.
Existujú 2 spôsoby podania koagulačného faktora, a to epizodické – pri krvácaní (tzv. „on demand“) alebo preventívne – buď pred záťažou alebo operáciou, k preventívnemu podaniu radíme aj profylaxiu. Profylaxia môže byť krátkodobá, kontinuálna (viac ako 45 týždňov v roku), primárna, sekundárna a terciárna.
Dávkovanie koncentrátu FVIII/IX vychádza z praktických skúseností a zohľadňuje stupeň deficitu faktora, typ, závažnosť a lokalizáciu krvácania alebo operácie, hmotnosť pacienta, typ produktu a jeho farmakokinetické vlastnosti (biologický polčas).
Ako zdôraznila MUDr. Jankovičová, profylaxia je dnes považovaná za zlatý štandard v liečbe pacientov s ťažkou hemofíliou, ako detských, tak dospelých. Pri začatí profylaxie je dôležité zodpovedať tieto otázky: kedy s profylaxiou začať, aký zvoliť typ koncentrátu FVIII/FIX a režim profylaktickej liečby. Špecifickou témou je tzv. terciárna profylaxia u pacientov predtým liečených „on demand“.
Na začiatku profylaxie nastavujeme pacientov na štandardný profylaktický režim podľa počtu IU/kg 2 – 3x týždenne (v detstve). V ďalšom priebehu života sa profylaktický režim mení podľa počtu krvácaní do pohybového aparátu za rok, neskôr k zmene profylaxie pristupujú individuálne požiadavky hemofilikov. V adolescentnom veku sa režimy profylaxie u jednotlivých pacientov väčšinou líšia.
Personalizovaná profylaxia je mnohostranná a vychádza z rôznych atribútov, ovplyvňuje ju nielen frekvencia krvácaní u pacienta a stav kĺbov, ale aj jeho fyzická aktivita a životný štýl, očakávania pacienta, vek, hmotnosť, prístup pacienta, adherencia k liečbe, žilový prístup a farmakokinetika. V minulosti boli hemofilici väčšinou invalidnými dôchodcami, dnes žijú hemofilici aktívny život porovnateľný so zdravými ľuďmi, v ktorom ich lekári podporujú. Fyzická aktivita pri hemofílii zlepšuje kvalitu života, pretože zlepšuje fyzickú kondíciu, flexibilitu kĺbov, svalovú silu, kostnú štruktúru a zlepšuje/zvyšuje sebavedomie. Zároveň fyzická aktivita znižuje hmotnosť, redukuje únavu a depresiu. S fyzickou aktivitou sa znižuje riziko spontánneho krvácania do kĺbov, znižuje sa riziko chorôb srdca, hrubého čreva a cukrovky 2. typu.
Pri profylaxii je pre pacientov kľúčový žilový prístup, pretože pri podávaní koncentrátu 2 – 3x týždenne od 1. – 2. roku života je to asi 150 venepunkcií za rok a takmer 5000 za 30 rokov života.
Ako uviedla MUDr. Jankovičová, u detí sa preferuje ako venózny prístup periférna žila a v Národnom hemofilickom centre majú skúsenosti aj s centrálnymi venóznymi katétrami, a to najmä v súvislosti s imunotolerančnou liečbou, pričom sa využívajú u pacientov port-a-cathy alebo externé tunelované centrálne venózne katétre (Hickman, Broviac). U dospelých sa taktiež preferuje periférny žilový prístup, avšak pri zlom žilovom prístupe poukázala MUDr. Jankovičová na dobré skúsenosti s periférne implantovanou centrálnou kanylou (PICC) u svojich 5 dospelých pacientov s hemofíliou.
MUDr. Jankovičová ďalej zdôraznila, že pri profylaxii je takisto dôležitá adherencia k liečbe, pričom v útlom detstve je adherencia k liečbe vysoká, neskôr, najmä v adolescencii sa znižuje.
Pri nastavení profylaxie u pacienta má nezastupiteľné postavenie farmakokinetika (PK), ktorá „mapuje“ osud liečiva od podania po vylúčenie a berie do úvahy individuálnu odpoveď pacienta na podaný liek. Biologický polčas je základným parametrom PK, informuje, za aký čas klesne koncentrácia liečiva z maximálne dosiahnutej koncentrácie na polovicuꓼ biologický polčas vykazuje inter- a intraindividuálne rozdiely.
Ďalšími dôležitými parametrami pri sledovaní farmakokinetiky je FVIII peak – maximálna hladina po podaní a FVIII trough – minimálna hladina po podaní FVIII. Veľkosť plochy pod krivkou medzi peak a trough tzv. area under the FVIII level curve (AUC) je dôležitá pri prevencii klinických a subklinických krvácaní, čím vyšší je through, tým nižší je počet krvácaní (graf 1).
Graf 1: Farmakokinetika – parametre pri zostavovaní personalizovanej profylaxie
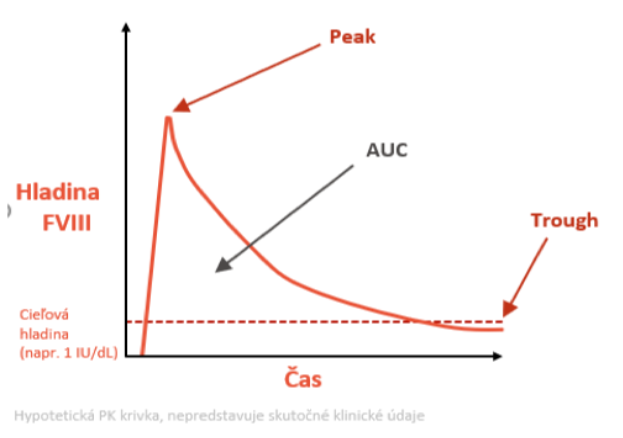
Farmakokinetika sa pre potreby individualizovanej profylaxie musí vyšetriť u každého pacienta, čo sa dnes uskutočňuje na základe populačných PK modelov na podklade tzv. Bayesovho odhadu, pričom stačí odobrať 1 – 3 vzorky bez wash-out periódy. Vieme stanoviť individuálnu PK krivku v 2 typoch dostupných programov : MyPKFit (program dimenzovaný pre produkty spoločnosti Takeda) a WAPPS Hemo (stanovenie PK pre všetky produkty).
MUDr. Jankovičová uviedla na klinickom príklade 3 možnosti na stanovenie individuálneho PK profilu a dávky u pacienta s HA v liečbe rekombinantným prípravkom pomocou programu MyPKFit, odobraté boli 2 vzorky, 3 a 24 hodín po podaní. Pacient mal dobrý biologický polčas FVIII 13,7 hodín a nízky klírens 2,8 ml/kg/hod. Ak sa v programe zvolil trough na úrovni 2% a podávanie FVIII u pacienta bolo nastavené na každých 48 hodín, v programe bola určená dávka 1 500 IU v režime každý druhý deň , pri tejto dávke by mal pacient hladinu FVIII nad 12% 13-15 hodín po podaní. Ak by sa zvolil trough na úrovni 1%, postačí u pacienta dávka 780 IU v režime každý druhý deň , avšak pri danom biologickom polčase pacienta sa uňho dosiahne peak FVIII iba 18%, čo nie je postačujúce pre fyzickú aktivitu. Treťou možnosťou v programe bolo nastavenie trough na úroveň 1% a podávanie á 72 hodín, v tomto prípade bola dávka určená na 2 500 IU v režime á 3 dni, pričom hladinu FVIII nad 12% by mal pacient 23 hodín po podaní.
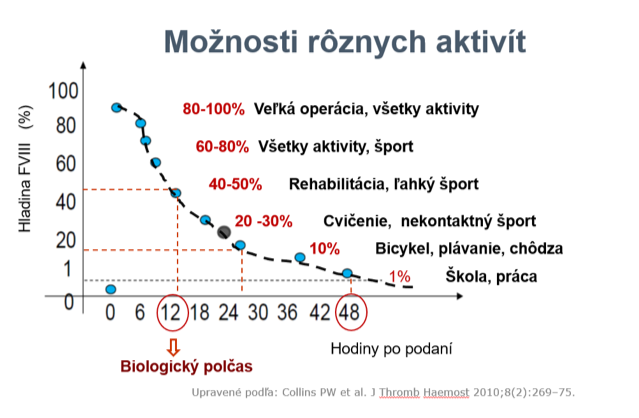
Pri stanovení krivky pre farmakokinetiku je potrebné si uvedomiť, že trough FVIII nad 1% chráni pacienta pred spontánnym krvácaním, nad 3% pred krvácaním do kĺbov a nad 12% by pacient nemal krvácať. Ak poznáme PK krivku, pacient sa môže venovať športovým aktivitám najmä po podaní profylaxie (graf 2).
Graf 2: Možnosti športových aktivít v závislosti od hladiny FVIII
MUDr. Jankovičová sa ďalej venovala prehľadu koncentrátov FVIII s predĺženým biologickým polčasom, ako uviedla, EHL-rFVIII spoločností Takeda a Sobi majú predĺžený biologický polčas 1,4 – 1,6 – násobne,. Pri EHL-rFVIII/FIX je dôležité poznať farmakokinetiku a uvedomiť si, čo chceme EHL-produktom dosiahnuť – či redukciu počtu podaní faktora, alebo v prípade, ak má pacient prelomové krvácania, potrebujeme zvýšiť trough. Redukcia počtu podaní má zmysel pre redukciu počtu venepunkcií u pacienta, aj pre zníženie ročnej spotreby prípravku.
V závere prezentácie MUDr. Jankovičová, PhD. zhrnula praktické aspekty manažmentu profylaktického režimu. Pri nastavovaní personalizovanej profylaxie je dôležitý pohovor s pacientom, monitoring hladín peak/trough, stanovenie inhibítora a farmakokinetiky (najmä pri EHL-rFVIII/FIX), vyšetrenie žilového systému a pochopenie princípu profylaxie pacientom. V priebehu profylaxie je nutné monitorovať minimálne hladiny, peaky, počty krvácaní za rok, zmenu životného štýlu, a to minimálne á 6 mesiacov.
Po prezentáciách pokračovala diskusia, v ktorej si kolegovia počas oboch workshopov vymenili aktuálne informácie o pacientoch s hemofíliou, ktorých starostlivosť zdieľajú s MUDr. Jankovičovou a Národným hemofilickým centrom.
V diskusii sme si potvrdili fakt, že pri liečbe s ohľadom na farmakokinetiku, sa pozoroval signifikantný rozdiel v odporúčanej dávke podľa veku, u menších detí sú potrebné vyššie dávky ako u detí vo veku nad 10 rokov.
Časť diskusie sa venovala aj téme personalizovanej profylaxie u športovcov a určitých limitov tejto profylaxie pri jednotlivých športoch, najmä pri kontaktných a vrcholových.
Diskusia pokračovala otázkami k zavádzaniu port-a-cathov. MUDr. Jankovičová spomenula vlastné skúsenosti s port-a-cathmi najmä pri podávaní imunotolerančnej liečby, uviedla ich výhody, aj limitácie, vrátane infekčných komplikácií, pri profylaktickej liečbe existujú aj dobré skúsenosti so zavedením PICC, a to aj pri terciárnej profylaxii u pacientov, ktorí boli predtým liečení on demand.
Ďalšia praktická otázka sa týkala vyšetrenia a transportu inhibítora, či vzorka krvi sa môže zamraziť a následne odoslať, odpoveď bola, že to je možné, vrátane odoslania do Národného hemofilického centra. Inhibítor je nutné vyšetrovať po 5.,10. a 20. expozičnej dávke faktora.
Posledná otázka v diskusii zaznela na tému používania mobilných aplikácií u adolescentov a mladých dospelých, podľa názoru MUDr. Jankovičovej, PhD. mobilné aplikácie zatiaľ neužíva vysoký počet adolescentov.
MUDr. Jaroslava Feketeová
VV-MEDMAT-29210

